Struttura di alcuni vetri di particolare importanza tecnologica
La struttura di un vetro propriamente detta è relativa all'arrangiamento atomico ed è in genere correlata macroscopicamente ad una singola fase, quando siamo in presenza di due o più fasi amorfe o cristalline ci si riferisce più propriamente alla "microstruttura" del materiale cioè ad un insieme di domini che possono essere cristallini od amorfi connessi da superfici e che danno luogo a una distribuzione di "grani" e di "pori", spesso accompagnati da difetti come bolle ecc..
1) vetri monocomponenti
1.1) vetro di silice SiO2
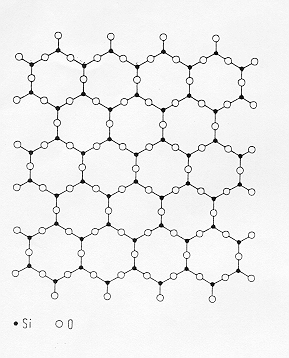
Nella figura 1§ 5.1 il modello strutturale del vetro di SiO2 è rappresentato da un network idealmente disordinato costituito dalla polimerizzazione dell’unità fondamentale tetraedrica ![]() in cui anelli di differenti dimensioni danno origine a lacune strutturali.. Questo modello ha trovato una conferma sperimentale nelle misure effettuate mediante diffrazione X a bassi angoli (SAXS) che hanno stabilito valori delle distanze di legame
in cui anelli di differenti dimensioni danno origine a lacune strutturali.. Questo modello ha trovato una conferma sperimentale nelle misure effettuate mediante diffrazione X a bassi angoli (SAXS) che hanno stabilito valori delle distanze di legame ![]() e degli angoli di legame
e degli angoli di legame ![]() (tipicamente intorno a 145°) compatibili con una struttura "aperta" del network , ad ulteriore conferma della presenza di lacune strutturali è stata dimostrata la facilità di diffusione di atomi di He nel vetro di silice.
(tipicamente intorno a 145°) compatibili con una struttura "aperta" del network , ad ulteriore conferma della presenza di lacune strutturali è stata dimostrata la facilità di diffusione di atomi di He nel vetro di silice.
Misure strutturali più accurate ( Gerber e Himmel) hanno dimostrato la presenza di anelli a 5 e 7 termini con una preferenza per quello a 5 che dimostrano la presenza di una struttura distorta derivata da quella della cristobalite high, sembra anche che le cavità presenti nel network tridimensionale abbiano la forma di un dodecaedro pentagonale distorto.
Figura 1 § 5.1
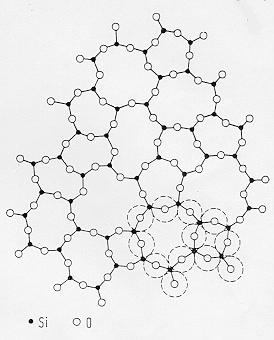
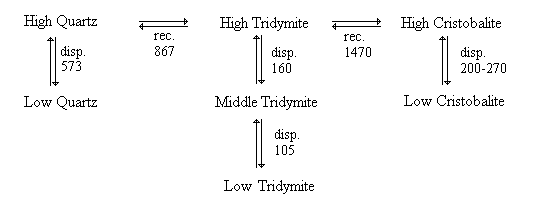
Dallo schema riportato in figura 2 la cristobalite-high è la struttura polimorfica della SiO2 stabile alla temperatura più alta.
Figura 2
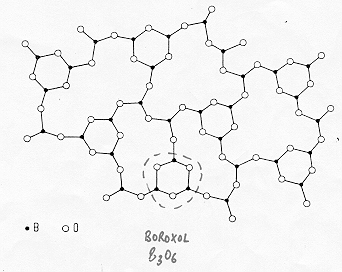
1.2) Il vetro di anidride borica B2O3
L’anidride borica B2O5 forma un vetro di elevata stabilità con scarsa tendenza alla cristallizzazione a causa delle forti differenze strutturali tra solido cristallino e vetro. L’unità base è costituita da un triedro planare ![]() che tende ad aggregarsi in gruppi di tre unità chiamati "boroxol"
che tende ad aggregarsi in gruppi di tre unità chiamati "boroxol" ![]() come è stato confermato da misure di diffrattometria a raggi X.
come è stato confermato da misure di diffrattometria a raggi X.
I gruppi boroxol sono legati tra loro da catene più o meno lunghe formate da atomi di boro e di ossigeno : poiché gli angoli di legame ![]() possono variare in un ampio range di valori i gruppi strutturali si legano tra di loro fuori dal piano dando origine ad un reticolo tridimensionale molto aperto. Come si può dedurre dall’osservazione del modello strutturale la stabilità di questo vetro in confronto a quella del vetro di silice è di gran lunga inferiore.
possono variare in un ampio range di valori i gruppi strutturali si legano tra di loro fuori dal piano dando origine ad un reticolo tridimensionale molto aperto. Come si può dedurre dall’osservazione del modello strutturale la stabilità di questo vetro in confronto a quella del vetro di silice è di gran lunga inferiore.
Figura 3
1.3) Vetro di GeO2
Sulla base del rapporto dei raggi ionici il sistema GeO2 è al limite tra la coordinazione 4 e 6: il cristallo assume due forme cristalline una stabile fino alla temperatura di 1049°C tipo rutilo (n=6) ed una tipo quarzo (n = 4) stabile fino alla temperatura di fusione di 1116° il fuso è molto viscoso e se raffreddato velocemente dà origine a vetri di struttura simile a quelli di silice in cui il Ge ha coordinazione 4.
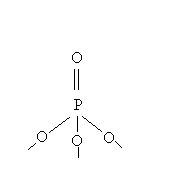
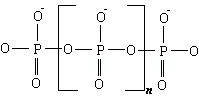
1.4) Vetro di P2O5
L’anidride fosforica forma un vetro con facilità ciò è dovuto alla presenza del gruppo tetraedrico ![]() in cui un ossigeno è legato al fosforo mediante il doppio legame.
in cui un ossigeno è legato al fosforo mediante il doppio legame.
Figura 4
2) Sistemi bicomponenti con la SiO2
A questi sistemi appartengono i vetri alcalino-silicatici, in questi sistemi l’aggiunta di una molecola di ossido alcalino come ad esempio Na2O porta alla distruzione di un ponte ad ossigeno con formazione di due ossigeni non a ponte come esemplificato in figura 5
Figura 5
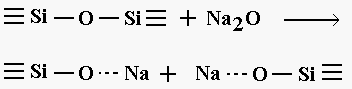
la formazione di ossigeni non a ponte provoca un indebolimento nella struttura; il legame dello ione Na+ é prevalentemente ionico quindi il legame ![]() è più debole del legame a ponte
è più debole del legame a ponte ![]() , lo ione Na+ , che porta ossigeni in eccesso che non si legano al silicio, tende a coordinare intorno a se ioni O2- assumendo un numero di coordinazione tra 6 ed 8 e quindi tende ad occupare le lacune del reticolo coordinandosi anche agli ossigeni a ponte adiacenti.
, lo ione Na+ , che porta ossigeni in eccesso che non si legano al silicio, tende a coordinare intorno a se ioni O2- assumendo un numero di coordinazione tra 6 ed 8 e quindi tende ad occupare le lacune del reticolo coordinandosi anche agli ossigeni a ponte adiacenti.
I limiti superiori della regione di formazione dello stato vetroso nel sistema ![]() variano dal 35% molare nel caso in cui R = Li al 55 % molare per gli altri ossidi alcalini anche se sono stati formulati sistemi multicomponenti con un tenore di SiO2 di appena il 30% molare per i quali si ipotizza che lo stato vetroso sia favorito da una struttura assai disordinata causata dalla competizione dei vari cationi nella coordinazione degli ossigeni.
variano dal 35% molare nel caso in cui R = Li al 55 % molare per gli altri ossidi alcalini anche se sono stati formulati sistemi multicomponenti con un tenore di SiO2 di appena il 30% molare per i quali si ipotizza che lo stato vetroso sia favorito da una struttura assai disordinata causata dalla competizione dei vari cationi nella coordinazione degli ossigeni.
Come già osservato la tendenza alla immiscibilità aumenta nella serie ![]() mentre la distribuzione degli ioni metallici sperimentalmente (NMR, Raman..) conferma l’esistenza di cluster metallici per definiti range composizionali come predetto da Bodvinkin.
mentre la distribuzione degli ioni metallici sperimentalmente (NMR, Raman..) conferma l’esistenza di cluster metallici per definiti range composizionali come predetto da Bodvinkin.
Vetri silicatici contenenti due (o più) specie di ioni alcalini presentano variazioni non lineari nelle loro proprietà : ad esempio la resistività elettrica presenta con determinati rapporti di specie ioniche massimi pronunciati, questo effetto chiamato "mixed-alkali effect" non ha avuto a tutt’oggi una esauriente spiegazione. Come vedremo la resistività elettrica di un vetro silicatico contenente quantità equimolari di Na2O e K2O (log s = 12,6) ![]() è circa il doppio di quella di un vetro sodio-silicatico
è circa il doppio di quella di un vetro sodio-silicatico ![]() .
.
3) Sistemi SiO2-RO-R2O
A questo sistema appartengono i vetri calcio-sodio-silicatici che stanno alla base delle formulazioni di vetri piani (lastre), anche in questo caso si ha con l’introduzione di ioni Ca++ la formazione di ossigeni non a ponte nel network continuo (figura 6).
Figura 6
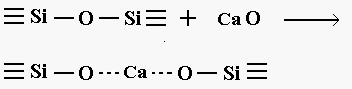
come vediamo dalla figura poiché il legame Ca-O è più forte di quello tra sodio ed ossigeno, i due ossigeni non a ponte mantengono un legame seppur debole attraverso lo ione calcio.
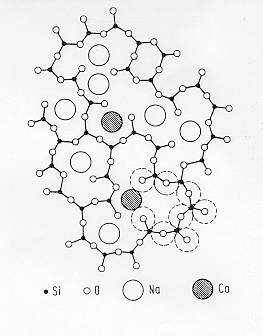
La figura 7§ 5.2a mostra la struttura un vetro sodio-calcio-silicatico: gli ioni dei metalli alcalini ed alcalino terrosi si dispongono nelle cavità del network del vetro di SiO2 tuttavia grazie alla presenza dello ione Na+ , fortemente "network modifier", il sistema forma facilmente una fase vetrosa. Il sistema binario CaO-SiO2 presenta invece nel diagramma composizionale ampie zone di devetrificazione.
Figura 7 § 5.2a
Con l’introduzione di MgO si può avere una stabilizzazione della fase vetrosa, in questo caso lo ione funziona da "network former" acquistando la coordinazione 4 dell’unità strutturale [MgO4]; il raggio ionico del Mg++ con il valore di 0,078 nm si trova in una posizione intermedia tra la coordinazione tetraedrica ed ottaedrica quindi la scelta delle due coordinazioni dipende strettamente dal rapporto molare con lo ione alcalino, sperimentalmente si è osservato che se ![]() allora lo ione Mg++ assume la coordinazione tetraedrica, al contrario assumerà quella ottaedrica comportandosi da "network modifier".
allora lo ione Mg++ assume la coordinazione tetraedrica, al contrario assumerà quella ottaedrica comportandosi da "network modifier".
Il comportamento dello ZnO è simile a quello visto per il MgO dato il raggio ionico intermedio tra la coordinazione 4 e 6 ( ri = 0,083 nm).
4) Sistemi vetrosi a base di ossido di piombo
I vetri ad alto contenuto di piombo costituiscono le due grandi famiglie dei vetri ottici: i vetri flint ed il cristallo, nel campo invece degli smalti ceramici abbiamo i fondenti e le fritte piombiche .
Nel sistema binario PbO-SiO2 si può avere formazione di vetro fino al 72 % molare in PbO (92 % in peso) tuttavia secondo la teoria del network continuo tutti i ponti ad ossigeno dovrebbero rompersi con una percentuale del network modifier del 66 %, in effetti una spiegazione a questa anomalia risiede nella struttura atomica dello ione Pb++: esso possiede due elettroni 6s nel guscio esterno (come il Tl+ ed il Bi+++ che hanno un comportamento simile) che sono responsabili della sua forte polarizzabilità. Lo ione Pb++ può infatti essere polarizzato dagli anioni ossigeno, in questo modo il guscio elettronico viene distorto e lo ione assume uno spiccato carattere dipolare (figura 8).
Figura 8
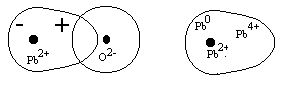
Allo stesso modo si può dire che un lato del dipolo abbia le caratteristiche del Pb0 mentre l’altro quelle dello ione Pb4+, quanto detto ci aiuta a capire il comportamento della superficie di vetri ad alto contenuto di piombo: lo ione Pb++ è a contatto degli ossigeni solo verso l’interno e ciò conferisce alla superficie del vetro un carattere spiccatamente metallico. La deformazione dello ione Pb++ è ancor più evidente nella cella cristallina (tetragonale) del PbO litargirio (figura 9).
Figura 9
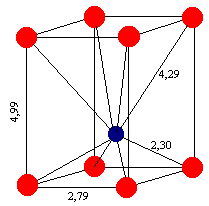
Quando i primi quattro ioni ossigeno si avvicinano allo ione Pb2+ all’inizio del processo di cristallizzazione si ha la polarizzazione dello ione con conseguente formazione del dipolo, come conseguenza di ciò i successivi ossigeni si disporranno ad una distanza superiore dallo ione Pb2+.
Nella tabella 1 vediamo il raggio ionico del Pb2+ e del Pb4+ e come questi influenzano il comportamento nel vetro
Tabella 1
|
Ione |
Raggio Ionico (Å) |
Forza di campo F (Z/a2) |
Funzione nel network |
|
Pb2+ |
1,32 |
0,27 |
Network Modifier |
|
Pb4+ |
0,84 |
0,8 |
Intermediate - Glass Former |
a basse concentrazioni di PbO lo ione Pb2+ agisce come un network modifier mentre a concentrazioni più alte peserà maggiormente la natura di vetro formatore dello ione Pb4+.
4.1) Sistemi fosfatici a base di piombo, effetto della retropolarizzazione
In vetri piombo-fosfatici il massimo contenuto in PbO che possiamo introdurre è del 66% mol, inferiore quindi a quello dei vetri silicatici; questo fatto può essere spiegato dalla forte retropolarizzazione del catione con alta carica P5+ (F= 2,1 contro F = 1,57 del Si4+) (figura 10).
Figura 10
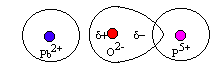
in questo caso è il P5+ che riesce a polarizzare lo ione O2- impedendo così la formazione del dipolo sullo ione Pb2+.
5) Influenza dell’aggiunta di ossidi del tipo R2O
5.1) Influenza dell’ossido di Alluminio
Il raggio ionico dello ione Al3+ è di 0,057 nm quindi il rapporto ![]() , secondo Pauling Al3+ sta al limite tra la coordinazione 4 e 6 ed anche in questo caso essa dipende dallo stato di legame dell’ossigeno; ad esempio in un vetro di silice lo ione alluminio aggiunto come ossido assumerà la coordinazione 6 [AlO6] in quanto gli ossigeni, legati fortemente alla silice sono solo debolmente polarizzabili, lo ione alluminio si comporterà in questo caso da network modifier, in un vetro sodio-silicatico lo ione alluminio potrà raggiungere la coordinazione 4 dell’unità [AlO4] in quanto gli ossigeni non a ponte qui presenti sono più facilmente polarizzabili funzionando da network former. Come già sappiamo è necessaria la presenza di ioni sodio monopositivi per compensare la valenza del gruppo [AlO4]-, allorché il rapporto molare tra Al3+ e Na+ supera 1 l’alluminio torna ad assumere la coordinazione 6.
, secondo Pauling Al3+ sta al limite tra la coordinazione 4 e 6 ed anche in questo caso essa dipende dallo stato di legame dell’ossigeno; ad esempio in un vetro di silice lo ione alluminio aggiunto come ossido assumerà la coordinazione 6 [AlO6] in quanto gli ossigeni, legati fortemente alla silice sono solo debolmente polarizzabili, lo ione alluminio si comporterà in questo caso da network modifier, in un vetro sodio-silicatico lo ione alluminio potrà raggiungere la coordinazione 4 dell’unità [AlO4] in quanto gli ossigeni non a ponte qui presenti sono più facilmente polarizzabili funzionando da network former. Come già sappiamo è necessaria la presenza di ioni sodio monopositivi per compensare la valenza del gruppo [AlO4]-, allorché il rapporto molare tra Al3+ e Na+ supera 1 l’alluminio torna ad assumere la coordinazione 6.
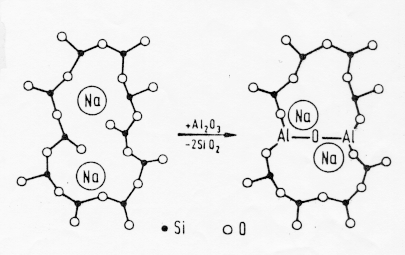
In figura 11 § 5.2b vediamo come la sostituzione di 2 SiO2 con 1 Al2O3 in un vetro sodio-silicatico porti al rafforzamento della struttura del network..
Figura 11 § 5.2b
5.2) B2O3 come ossido formatore di vetro
Nei sistemi alcalino-boratici l’ossido di boro B2O3 funziona da network former secondo il seguente meccanismo: prendiamo ad esempio un vetro sodio-boratico Na2O-B2O3 ; inizialmente il boro ha una coordinazione 3 tipica del vetro di anidride borica, un aumento della percentuale dell’ossido alcalino aggiunto determina tuttavia il passaggio del boro dalla coordinazione 3 a 4 [BO3]® [BO4] con conseguente "rafforzamento" della struttura del network. Quando lo ione alcalino diventa in eccesso prevale sulla struttura del vetro l’effetto degli ossigeni non a ponte che si vanno formando a causa del network modifier e quindi lo ione boro tende a ritornare alla coordinazione 3 e la struttura si indebolisce. In figura 12 § 5.3 si può vedere la precentuale di atomi di boro in coordinazione 4 all'aumentare della percentuale di network modifier (Na2O), nella parte inferiore della stessa figura è riportato il meccanismo della formazione di ossigeni non a ponte ad alte percentuali di ossidi alcalini aggiunti.
Figura 12 § 5.3.
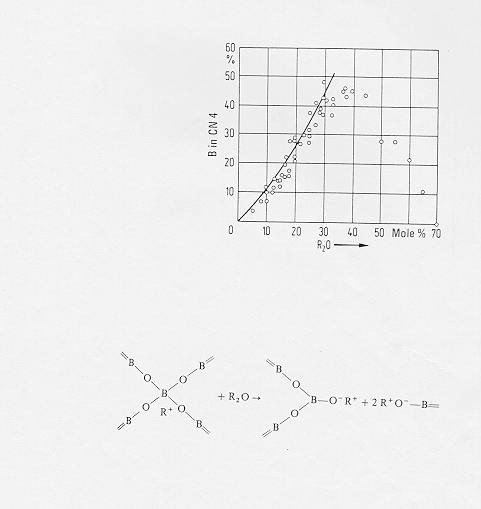
5.3) Effetto dell’aggiunta di B2O3 a vetri alcalino-silicatici
In questi casi l’aggiunta di B2O3 a sistemi ricchi di ossigeni non a ponte ha effetti simili all’aggiunta di Al2O3 (formazione di gruppi [BO4] con conseguente rafforzamento del network e saturazione della valenza da parte degli ioni R+ - con R = metallo alcalino-)
5.4) Vetri fosfatici
Essi non hanno l’importanza tecnologica dei vetri silicatici a causa della loro scarsa stabilità chimica, la loro applicazione è limitata a particolari vetri ottici, a vetri con alto potere di assorbimento del calore, vetri resistenti all’attacco fluoridrico a vetri per dosimetri di radiazioni.
Come si è già visto la P2O5 forma sotto determinate condizioni di raffreddamento un vetro che ha solo un interesse scientifico, ricerche condotte con i raggi X hanno dimostrato che questo vetro ha come unità fondamentale il gruppo [PO4] ma che, a causa del doppio legame ![]() , solo 3 dei quattro vertici del tetraedro siano connessi, questo porta una spiccata tendenza alla formazione nella struttura del vetro di catene con angoli
, solo 3 dei quattro vertici del tetraedro siano connessi, questo porta una spiccata tendenza alla formazione nella struttura del vetro di catene con angoli ![]() di 140°.(Figura 13)
di 140°.(Figura 13)
Figura 13
I vetri alcalino-fosfatici sono solubili in acqua essi vengono distinti in vetri polifosfati, metafosfati,ed ultrafosfati.
L’aggiunta di Al2O3 nel sistema Al2O3- P2O5 forma vetri stabili dove la combinazione dell’alluminio trivalente e del fosforo pentavalente permette, in una coordinazione tetraedrica, una struttura vicina a quella della silice pura. In effetti l’alluminio ortofosfato cristallino AlPO4 è isostrutturale con la SiO2
5.5) Vetri contenenti ossido di arsenico e di antimonio
Per lungo tempo As2O3 è stato aggiunto in basse concentrazioni (2-3 %) a vetri commerciali come agente di "refining", il meccanismo alla base di questa sua proprietà è la capacità di rilasciare ossigeno alla temperatura di circa 1400°C dalla specie As2O5 formatasi a più bassa temperatura dalla combinazione di As2O3 ed ossigeno come descritto dalla reazione:
![]()
l’ossigeno è il principale componente delle bolle all’interno del fuso: esse vengono assorbite dall’anidride arseniosa As2O3 per formare anidride arsenica As2O5, il processo è inoltre reversibile a temperature alte e quindi l’ossigeno viene rilasciato ad alta temperatura quando il vetro ha una bassa viscosità. In questo modo l'ossigeno che fugge dal fuso ha una funzione anche di lavaggio e di mescolamento (fase di refining). Il sistema con l’ossido di antimonio si comporta in maniera analoga a quello con l’ossido di arsenico anche se è meno tossico e per questo ha completamente sostituito quest’ultimo come agente di "refining" nella moderna tecnologia vetraria.
5.6) Vetri a base di TeO2
Si devono ricordare qui i vetri a base di ossido di tellurio TeO2 che possiedono proprietà ottiche estreme rispetto a normali vetri silicatici, quali ad esempio un indice di rifrazione nd = 2,1-2,3 con un numero di Abbe n d = 15-18, inoltre essi possiedono un ottima trasmissione ottica nel visibile e vicino infrarosso fino a circa 7000 Å, ciò ha reso questi sistemi importante nello sviluppo di apparecchiature scientifiche.
Nella tabella 2 sono riportate le proprietà ottiche di alcuni sistemi binari a base di ossido di tellurio:
Tabella 2
|
Sistema |
Secondo componente (mol%) range composizionale |
r ( |
nd |
n d |
|
Na2O-TeO2 |
5,5 37,8 |
5,430 4,143 |
2,1483 1,8006 |
17,0 22,2 |
|
BeO- TeO2 |
16,5 22,7 |
5,357 5,246 |
2,1095 2,0749 |
18,4 19,1 |
|
Tl2O- TeO2 |
13,0 38,4 |
6,262 7,203 |
2,1902 2,2800 |
15,9 11,3 |
|
PbO- TeO2 |
13,6 21,8 |
6,054 6,303 |
2,2018 2,2056 |
16,5 16,4 |
|
La2O3- TeO2 |
4,0 9,9 |
5,662 5,707 |
2,1596 2,1082 |
17,6 19,5 |
|
Nb2O5- TeO2 |
3,6 34,4 |
5,558 5,159 |
2,1924 2,2113 |
16,7 15,7 |
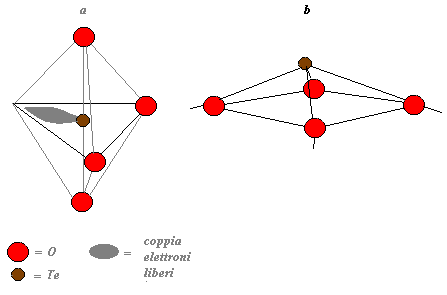
La struttura di questi vetri è stata descritta come una distorsione del reticolo cristallino della para-(a) tellurite nella quale l’atomo di tellurio occupa il centro di una bipiramide trigonale di ossigeni con uno spigolo non occupato (figura 14)
Nella figura a vediamo l’unità strutturale [TeO4] della paratellurite cristallina con lo ione Te4+ nella coordinazione 4, nella figura b vediamo l’unità strutturale dei vetri a base di tellurio.
I poliedri nel vetro come vediamo sono connessi solo per gli spigoli mentre la distanza ![]() è di 0,2 nm e gli angoli
è di 0,2 nm e gli angoli ![]() deviano da 180° di ben 30° nel piano equatoriale e fino a 20° dall’angolo di 120° al vertice con lo ione tellurio, per queste ragioni non è possibile ottenere un vetro raffreddando in condizioni convenzionali del TeO2 puro mentre relativamente piccole aggiunte di altri ossidi permettono ai poliedri di connettersi in strutture a catena.
deviano da 180° di ben 30° nel piano equatoriale e fino a 20° dall’angolo di 120° al vertice con lo ione tellurio, per queste ragioni non è possibile ottenere un vetro raffreddando in condizioni convenzionali del TeO2 puro mentre relativamente piccole aggiunte di altri ossidi permettono ai poliedri di connettersi in strutture a catena.
Figura 14
5.7) Influenza degli anioni sulla struttura del vetro
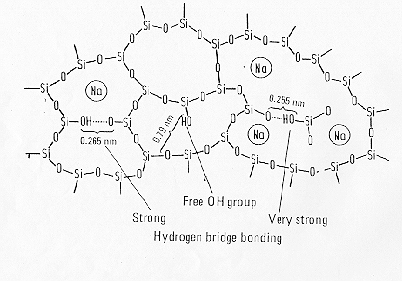
Lo ione ossidrile OH- si comporta nei confronti del legame O-Si-O del network come un "network modifier" secondo la reazione descritta in figura 9
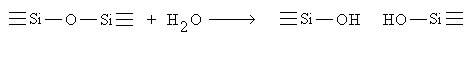
Questo meccanismo è stato confermato da studi mediante spettroscopia IR con i quali si è visto che la solubilità dell’acqua in un vetro è proporzionale alla radice quadrata della pressione parziale di vapore ![]() . I gruppi ossidrili sono tuttavia legati più fortemente nel network di quanto non lo siano i cationi alcalini (figura 15 § 5.4) a causa del legame ad idrogeno -OH.....H. In un vetro sodio-silicatico alla PH2O = 1013 mBar e 1400 °C la solubilità dell’acqua è pari a 0,35 mol% mentre a temperatura ambiente è di soli 0,05 mol%.
. I gruppi ossidrili sono tuttavia legati più fortemente nel network di quanto non lo siano i cationi alcalini (figura 15 § 5.4) a causa del legame ad idrogeno -OH.....H. In un vetro sodio-silicatico alla PH2O = 1013 mBar e 1400 °C la solubilità dell’acqua è pari a 0,35 mol% mentre a temperatura ambiente è di soli 0,05 mol%.
Figura 15 § 5.4
Anche lo ione F- si comporta come gli ioni OH-, il meccanismo previsto è quello della formazione nel network di gruppi del tipo
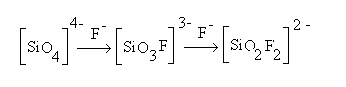
l’unità tetraedrica fondamentale è ancorata al reticolo da non più di tre ossigeni invece che da quattro e questo rende la struttura del vetro più debole.
Un meccanismo analogo è teorizzato per i vetri sodio-allumino-silicatici nei quali lo ione fluoro forma complessi con la silice e l’allumina.
Lo ione solfato [SO4]2- viene introdotto nel batch come Na2SO4 oppure come SO3 o SO2+O2 dalla atmosfera del forno; in genere perché si abbia assorbimento sulla superficie del vetro lo ione solfato deve poter avere vicini due ioni alcalin od un ione alcalino-terroso in modo da saturarne la valenza, in un vetro comune la massima quantità rilevata è dell’1% in peso.
Nei vetri in genere vengono chiamati gas chimicamente dissolti le sostanze gassose quali SO3, H2O, CO2 che si legano chimicamente al network, mentre i gas fisicamente disciolti sono quelle sostanze per le quali si parla di adsorbimento delle molecole negli spazi vuoti del reticolo strutturale, nel caso dei sistemi vetrosi questa classe di sostanze è limitata solo all He che possiede un atomo sufficientemente piccolo da penetrare nella struttura vetrosa.